导读

2021年1月28日,裕策生物的“基于免疫编辑的优化新抗原负荷模型用于预测免疫检查点治疗响应和预后”的研究项目以featured poster形式发表在WCLC2020会议上。下面,小编就为大家详细解读这项研究结果。
题目
An Optimized Neoantigen Load Model Based on Immune Editing to Predict Response and Prognosis of Immune Checkpoint Therapy
背景
以CTLA-4、PD-1和PD-L1为靶点的免疫检查点抑制剂(ICIs)可促进T细胞的抗肿瘤反应,多款药物已经在国内外获批。但是免疫治疗也存在有效人群不高、耐药、超进展等问题,这使得迫切需要寻找有效的生物标记物来选择潜在的应答者。目前被广泛接受的生物标志物(例如PD-L1、TMB)其实并不够完善,一些TMB较低或PD-L1阴性的患者仍能从免疫检查点抑制剂中获益。最近越来越多研究发现,新生抗原可以在免疫选择的压力下通过多种免疫编辑的机制引起肿瘤免疫逃逸。因此,整合基因组特征和免疫编辑的方法可能会更准确地捕获免疫检查点抑制剂期间癌症和免疫逃逸之间的相互作用,并解释对治疗的反应。
肿瘤的免疫编辑理论
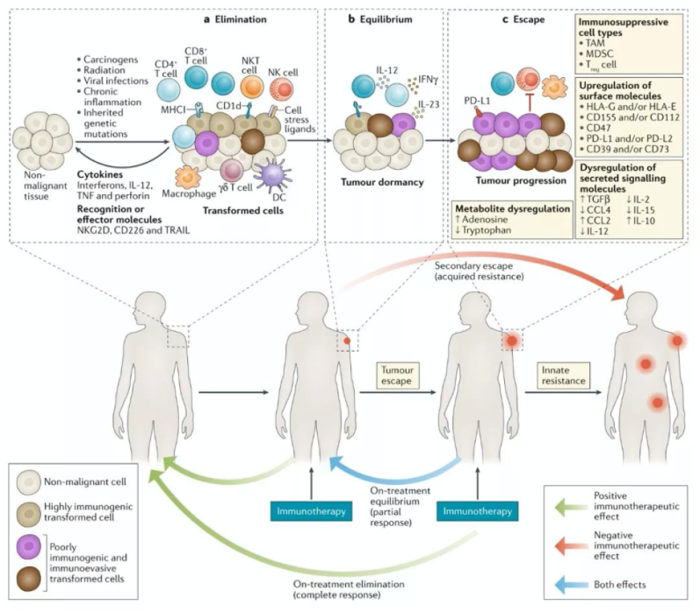
在介绍该研究前,需要引入一个重要概念,即肿瘤免疫编辑理论(Cancer Immuno-editing)。肿瘤细胞在机体内的发生、发展是与免疫系统相互作用的动态过程,免疫系统不仅具有清除肿瘤细胞的能力,而且还具有促进肿瘤生长的作用[1]。
免疫编辑共分为三个阶段:清除(Elimination),平衡(Equilibrium),逃逸(Escape)。
• 清除阶段
固有免疫和特异性免疫协同作用,DC、NK、巨噬细胞、效应T细胞等识别并消灭肿瘤细胞。
• 平衡阶段
个别的肿瘤细胞克隆因其免疫原性低或其他原因,躲过了清除阶段,肿瘤进入平衡阶段,即肿瘤生长停滞。一般认为主要由特异性免疫维持这个平衡,而固有免疫机制不参与该阶段。
• 逃逸阶段
肿瘤细胞基因组是非常不稳定的,随着免疫系统持续的选择压力,越来越多的癌细胞克隆拥有了躲避免疫系统识别或消除的能力,如MHC和/或肿瘤抗原肽表达缺失,肿瘤生长逐渐不受控制,最终发病[2]。
免疫治疗ioTNL算法
根据肿瘤免疫编辑理论,具有免疫清除能力的肿瘤克隆可以被T细胞识别并清除,而经过免疫编辑的肿瘤克隆一般会具有较高的突变载荷,会通过HLA基因杂合性缺失或减少新生抗原呈递通路的基因表达等机制下逃避免疫监控。
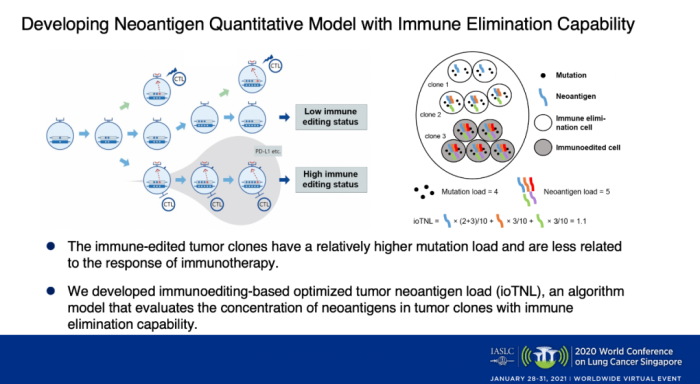
根据免疫编辑理论,我们开发了一个基于免疫编辑优化的肿瘤新生抗原负荷算法(ioTNL),该算法模型可评估具有免疫消除功能的肿瘤克隆中新生抗原的丰度。ioTNL的计算:排除掉经过免疫编辑的克隆所产生的新生抗原负荷,而将来自免疫清除状态克隆的新生抗原按照其所占的肿瘤细胞丰度相加。
结果
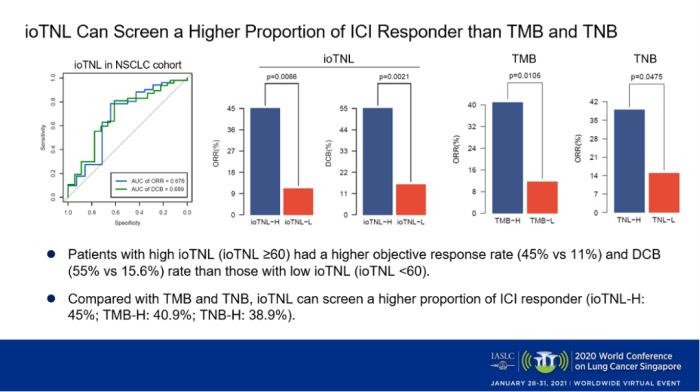
首先,我们在65例经过免疫治疗的NSCLC队列中探索ioTNL的作用,发现临床获益患者的ioTNL明显高于无响应患者(p=0.045),并且高ioTNL(≥60)的患者有较高的客观缓解率(p<0.01)。与TMB和TNB相比,ioTNL能够筛选出更高比例响应免疫治疗的患者(ioTNL-H: 45%; TMB-H: 40.9%; TNB-H: 38.9%)。
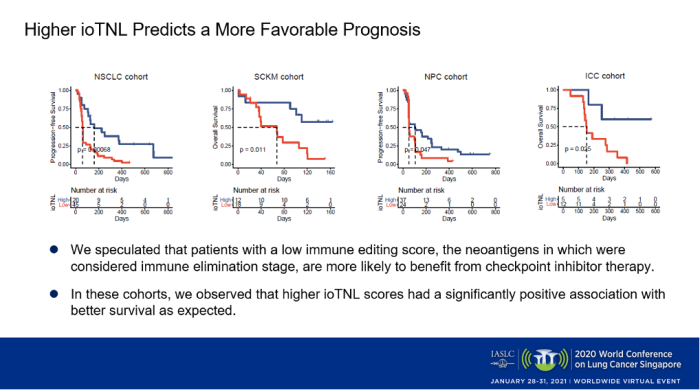
我们还在另外三个ICIs治疗的队列中(黑色素瘤,鼻咽癌和肝内胆管癌)验证了ioTNL。同样地,我们发现ioTNL表现出了其对免疫治疗疗效的预测性能。在预后水平上,我们也观察到ioTNL评分高的患者在所有四个队列中都与更好的生存显著相关(p<0.05)。
结论
本研究通过鉴定具有免疫清除功能的肿瘤克隆,开发了一个基于免疫编辑优化的肿瘤新抗原负荷模型(ioTNL),探索了ioTNL与肿瘤免疫治疗响应之间的关系。本研究在四个免疫治疗的队列中发现并验证了高ioTNL评分与临床客观缓解相关,是患者的重要预后因素。而且ioTNL相较于TMB和TNB能够筛选出更高比例响应免疫治疗的患者也表明了肿瘤免疫编辑在T细胞的抗肿瘤反应中起到了不容忽视的抑制作用,影响了患者对ICIs的应答。所以ioTNL有望成为预测患者免疫检查点抑制剂治疗疗效和预后的新biomarker。
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

