2018年对肿瘤免疫治疗来说,是不平凡的一年,肿瘤免疫治疗取得了突飞猛进的发展。还有几个小时,2019年就要到来了。今天,我们挑选出了2018年肿瘤免疫方面的十大热点,用这些热点勾勒出肿瘤免疫治疗在这一年的模样。
TOP1
癌症免疫疗法获2018年诺贝尔生理学或医学奖
瑞典卡罗琳医学院2018年10月1日宣布,将2018年诺贝尔生理学或医学奖授予美国科学家詹姆斯·艾利森和日本科学家本庶佑,以表彰他们在癌症免疫治疗方面所做出的开创性贡献。美国德克萨斯大学安德森癌症中心詹姆斯·艾利森教授的突出贡献在于发现CTLA-4的“分子刹车”作用,抑制该分子将解除T细胞的抑制,继而攻击肿瘤细胞。日本免疫学家本庶佑则为目前肿瘤免疫治疗领域明星分子PD-1的发现者。
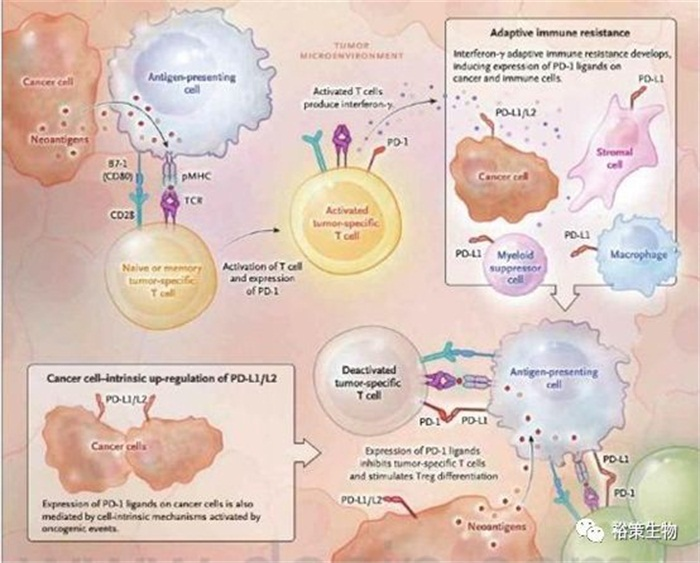
评奖委员会介绍,两名科学家“松开”了人体的抗癌“刹车”,让免疫系统能全力对抗癌细胞,“现在已彻底改变了癌症疗法”!
TOP2
四款抗癌药相继在中国获批上市:
Keytruda®、Opdivo®、拓益®和达伯舒®
2018年7月25日和2018年8月28日默沙东的Keytruda®和百时美施贵宝的Opdivo®相继在中国上市,从此中国开启了肿瘤免疫治疗的新时代。
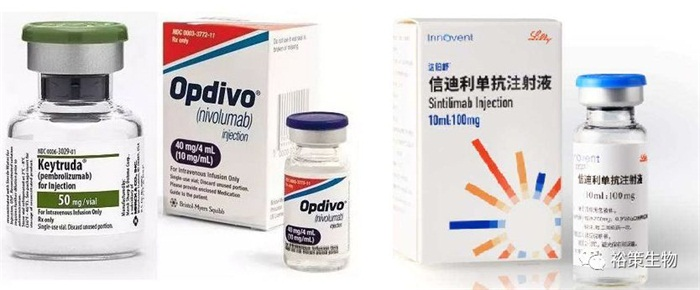
2018年12月17日,由苏州众合生物医药股份有限公司(君实生物子公司)研制开发的首个国产PD-1单抗——特瑞普利单抗注射液(商品名:拓益®) 获得国家药品监督管理局的批准上市。用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
10天后,2018年12月27日信达生物制药与礼来制药共同宣布,双方共同开发的创新肿瘤药物达伯舒®(重组全人源抗PD-1单克隆抗体,国际商标:Tyvyt®,化学通用名:信迪利单抗注射液)正式获得国家药品监督管理局的批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。
TOP3
基于新生抗原的个性化疫苗在脑胶质母细胞瘤上再获突破
2018年12月19日在顶级期刊《Nature》上同日刊登了两篇文章:在单独的I期临床试验中,新诊断的胶质母细胞瘤患者接受了含有特异性新生抗原的个性化疫苗的治疗,所述新生抗原特异于个体自身肿瘤,结果发现治疗可以增强免疫细胞对胶质母细胞瘤的反应。研究结果还指出了如何改善这种疗法,包括与PD-1抑制剂的联用。
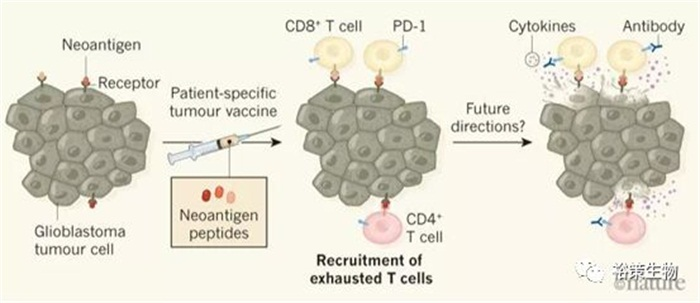
其中德国海德堡大学医院的科学家,使用根据患者肿瘤中新生抗原突变定制的个性化疫苗,治疗新诊断的胶质母细胞瘤患者,15名患者的中位总生存期为29.0个月,PFS时间达到14.2个月,患者最长生存期超过38.9个月。而美国波士顿达纳-法伯癌症研究所的科学家,也使用新生抗原靶向疫苗治疗胶质母细胞瘤患者,激活了循环中的T细胞,并让其进入大脑,杀伤脑部胶质瘤细胞,患者中位生存期也达到了16.8个月。
TOP4
基于新生抗原的过继性细胞治疗“治愈”晚期实体瘤
2018年6月《Nature》子刊《Nature Medicine》所刊登的一项重磅研究,美国国立卫生研究院(NIH)国家癌症研究所(NCI)Steven Rosenberg博士将T细胞免疫疗法首次成功应用于晚期乳腺癌。
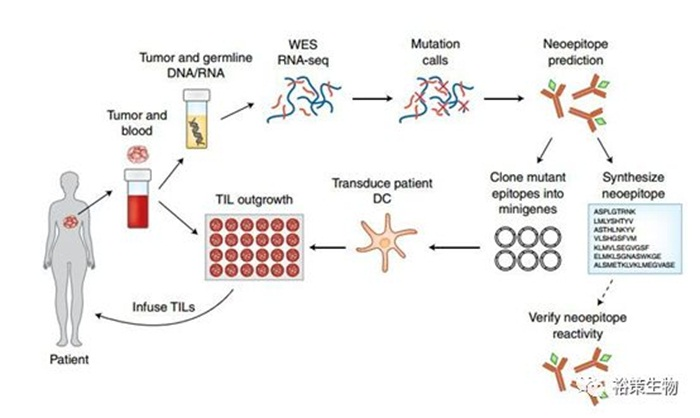
研究者从患者的肿瘤中提取了淋巴细胞,并从中筛选出对突变癌细胞有反应的特定类型——肿瘤肿瘤浸润淋巴细胞,该细胞对四种突变蛋白(SLC3A2、KIAA0368、 CADPS2 和 CTSB)具有反应性。随后,研究人员在实验室中对这些细胞进行了修饰,再回输到患者体内。这些特定类型的淋巴细胞在实验室中被激活,并与免疫检查点抑制剂相结合,形成了一种“高度个性化”的抗癌疗法。采用这种联合疗法,患者的肿瘤出现了完全消退。
TOP5
肿瘤突变负荷(TMB)首次被写进NCCN指南
2018年11月21日推出的非小细胞肺癌NCCN指南中,TMB赫然在列,成为非小细胞肺癌患者接受免疫治疗的推荐生物标志物。
肿瘤的发生发展很多时候和基因在重要的编码序列发生突变相关。肿瘤突变负荷TMB,是肿瘤基因组编码区中平均每百万碱基区域中检测到的体细胞突变数量。TMB越高,那么可能相应的肿瘤相关的致癌突变越多,每个肿瘤的个性就越突出,越不同于正常细胞。

最新的NCCN指南 2019 V.1版本新增肿瘤突变负荷(TMB)用于识别适合接受“纳武利尤单抗+伊匹单抗”双药联合免疫治疗 和“纳武利尤单抗”单药免疫治疗的肺癌患者。
TOP6
LAG-3可能是另一个重要的免疫检查点抑制剂药物靶点
2018年12月21日,耶鲁大学陈列平教授团队(第一作者为王俊博士)在Cell上发表了题为Fibrinogen-like Protein 1 Is a Major Immune Inhibitory Ligand of LAG-3的论文。证明了纤维介素蛋白1(Fibrinogen-like protein 1, FGL1)是LAG-3的一个重要的功能性配体,并揭示了该LAG-3-FGL1通路在肿瘤免疫中的作用。
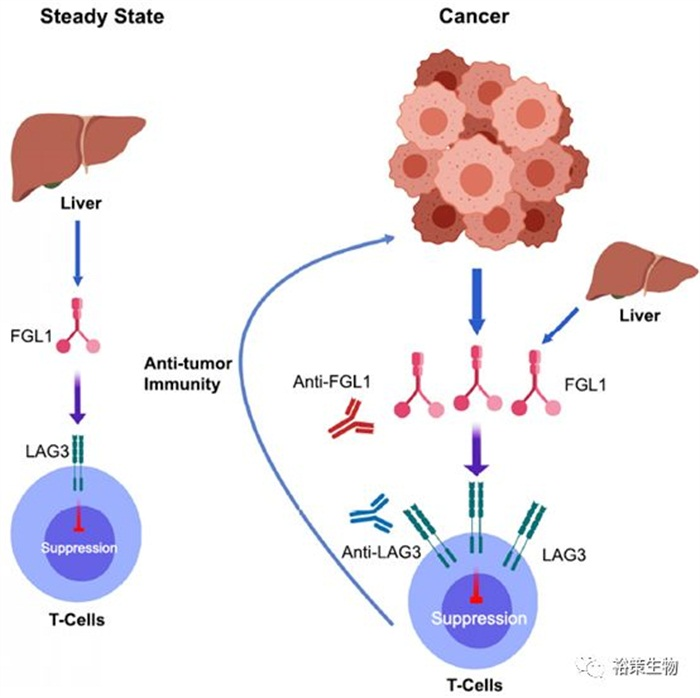
本研究发现并证明了FGL1-LAG-3是肿瘤免疫逃逸的一条新通路,且可作为肿瘤免疫治疗的潜在靶点。
TOP7
陈列平提出肿瘤“免疫正常化”理念
2018年10月耶鲁大学医学院陈列平教授在《Cell》杂志上发表了一篇题为“A Paradigm Shift of Cancer Immunotherapy: From Enhancement to Normalization”的展望文章,详尽阐述了肿瘤免疫治疗的历程、方法和现状,以及“免疫正常化”这一理念对未来肿瘤免疫治疗的指导作用。
免疫增强化(Enhancement),即增强正常的免疫机制,就是传统意义上不断扩大和增强免疫的过程;免疫正常化(Normalization),即矫正缺陷的免疫机制,则是使免疫回归人体自然的水平。
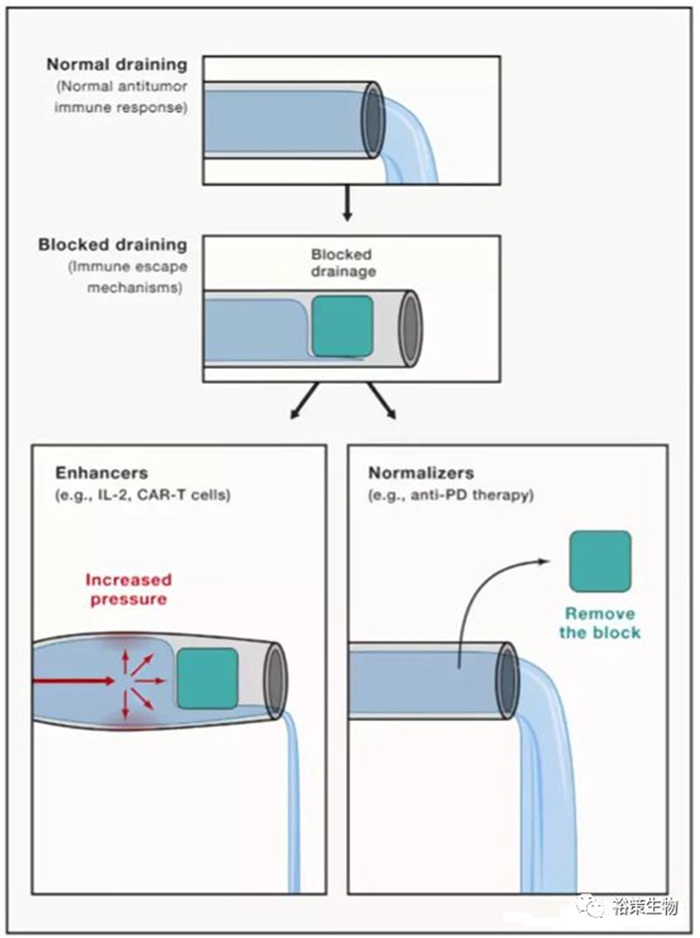
比如水管系统,正常情况下,水的流入和排出都保持一个稳态,然而当水管中出现了一个阻碍,水的流动就会被阻断。免疫反应可以比喻成这样的一个水管系统,某处被阻断后,肿瘤细胞便无法被免疫细胞清除。目前,有两种截然不同的方法试图解决此问题。一是免疫增强,免疫增强就是加大水压,增加管内压力,把整体的免疫反应增强到一个新的高度,当管内压强过高,超过了患者的承受能力时,就会造成毒副作用(水管破裂);另外一种方法就是免疫正常化,即选择性地移除局部阻碍,而不增加整个免疫系统的反应,使水管回复畅通状态,目前的抗PD疗法就是选择性地移除肿瘤附近微环境的免疫抑制,使效应T细胞恢复工作状态。
TOP8
全新TIDE算法可预测肿瘤免疫治疗效果
2018年8月《Nature》子刊《Nature Medicine》所刊登的一项研究,哈佛大学公共卫生学院生物统计与计算生物学系,联合Dana-Farber肿瘤研究所功能性癌症表观遗传组学中心,开发了一种新算法:肿瘤免疫功能失调与排斥(TIDE),这一方法能通过特征基因(gene signature)的表达,该算法整合了T细胞功能失调和T细胞浸润受阻的特征基因,为肿瘤免疫逃避构建数学模型。
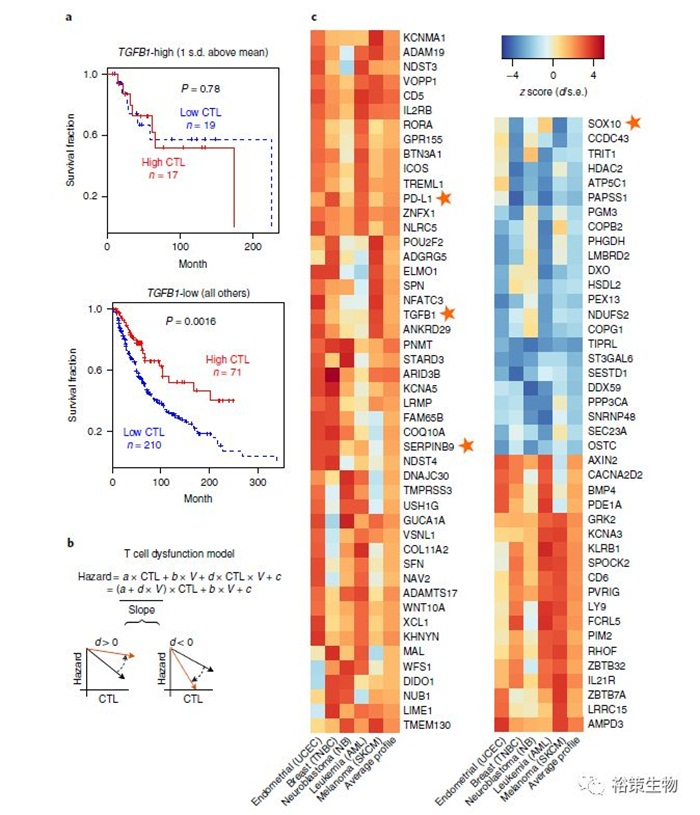
TIDE算法可以作为新的生物标志物预测免疫检验点抑制剂疗法的响应情况。并且通过TIDE的预测,还能帮助筛选免疫检验点抑制剂耐药性的调节因子,为进一步解决免疫治疗的耐药性提供基础。
TOP9
降解PD-1蛋白带来新的PD-1通路疗法
2018年11月《Nature》杂志上刊登了一项的重磅成果,来自中科院生物化学与细胞生物学研究所的许琛琦课题组揭示了PD-1经泛素化降解的通路,确定了一个关键酶FBXO38,并描述了其在调节T细胞抗癌功能中的作用。
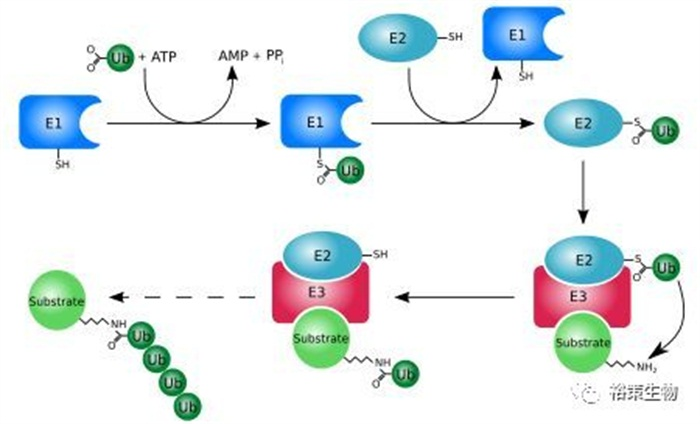
在人类肿瘤组织和癌症小鼠模型中,FBXO38转录水平均有所下降,添加IL-2则能恢复转录水平从而下调PD-1,这很有希望带来新的PD-1通路疗法!
TOP10
CAR-T“杀人风暴”可得到控制
2018年12月《Nature》杂志上刊登了一项来自约翰·霍普金斯大学团队的成果,研究者们发现细胞因子释放与肾上腺素等儿茶酚胺类物质有关,限制其合成可以有效控制细胞因子风暴(CRS)发生!
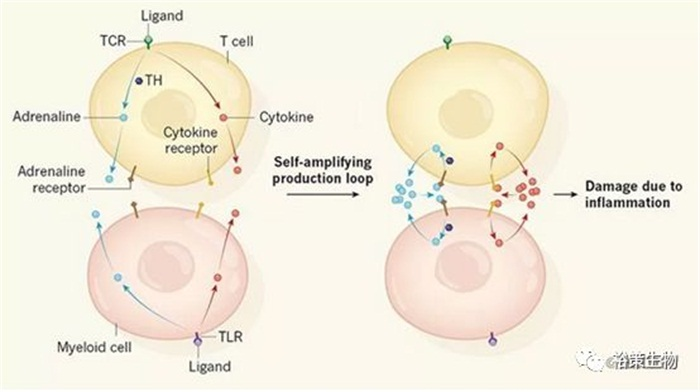
在多种免疫治疗癌症的小鼠模型中,这种方法都能够降低细胞因子产生、增加存活率,同时并未影响到治疗效果。
【 返回列表 】
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

