
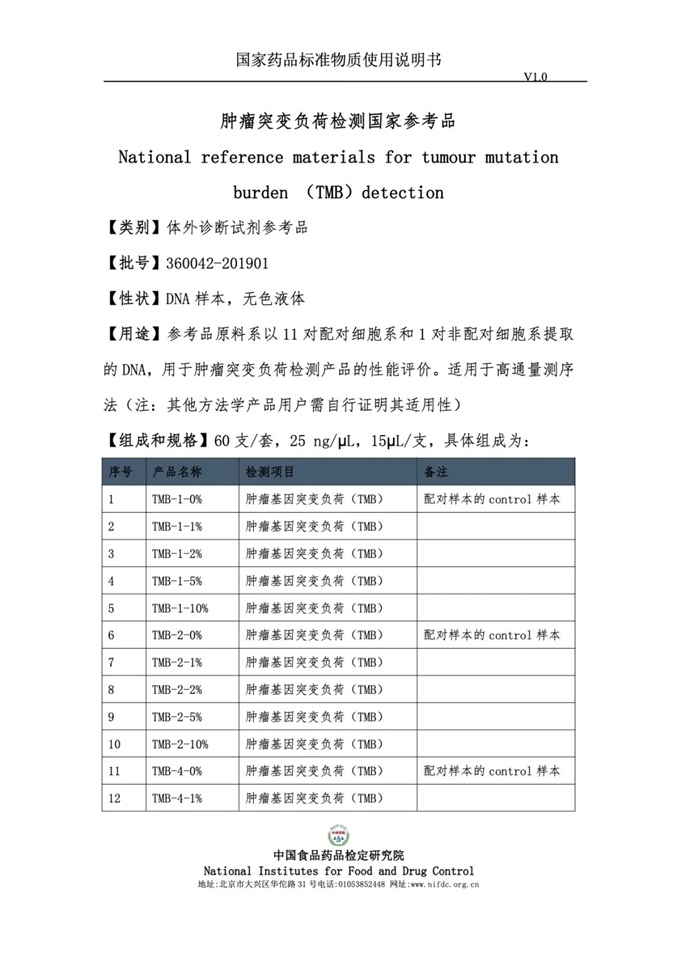
2019年10月15日,中检院公示了TMB体外诊断试剂国家标准品和参考品说明书征求意见稿,为TMB试剂盒注册检验的开展提供了有力保障。一直以来,裕策生物积极参与中检院TMB检测标准品/参考品的标定工作,为TMB注册检验流程的制定贡献了自己的力量。此次中检院正式公布裕策生物作为TMB国家标准品协作单位,说明裕策生物的专业能力得到了国家权威机构的认可,未来将引领并规范行业TMB检测标准。


相关链接
中国食品药品检定研究院《关于公布第八期注册检验用体外诊断试剂国家标准品和参考品目录的通知》
https://www.nifdc.org.cn/nifdc/twowebsite/twobzwz/twobzwztzgg/20200416160819529.html
关于裕策生物
裕策生物秉承以患者为中心,改善肿瘤诊疗为己任,“让肿瘤免疫更有效”为使命,围绕肿瘤精准免疫治疗的基因检测服务,以“基因”+“免疫”为双翼,将肿瘤基因组、免疫微环境有机结合,是肿瘤精准免疫治疗基因检测的先行者与开拓者。
自成立以来,裕策生物完成三轮共计数亿元融资,建设了第三方医学检验所,布局江苏IVD研发生产基地,搭建自有营销团队,业务覆盖了40多个城市,200余家医院,并累计申请国内外专利发明20余项,软件著作权20余项。
裕策生物是国内最早提供TMB检测的公司(2016年),国内首个提出肿瘤新生抗原负荷(TNB)检测的公司(2017年2月),国内肿瘤免疫治疗基因数据积累最多的检测公司(4000+)和国内最早进行肿瘤免疫治疗疗效动态监测研究的检测公司,专注服务于临床,辅助诊疗。
2017年,裕策生物携手詹启敏院士联合启动中国抗癌·天梯计划。作为国内首个专为肿瘤免疫治疗而发起的基因组合作计划,旨在推动基于临床数据的肿瘤免疫治疗特异性抗原及生物标志物的开发和利用。其中,裕策生物与华西医院、上海市第十人民医院同济大学附属第十人民医院合作个体化疫苗项目荣获2018年中国医药生物技术十大进展。
未来,裕策生物将不忘初心,以专业的态度对待每一份期待,为医生和患者提供最优质的服务,让肿瘤免疫更有效!
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

