
导言
我们所处的医学临床研究领域,面对的问题往往可能是研究一个生理或病理机制,探索各干涉性的因素所发挥的作用,涉及单个或多个生物学现象;要考虑的因素不仅是项目课题的科学价值,还包括样本(队列)的挑选、临床信息与样本质量数量、组学的选择、每个组学的技术路线;最后,还需要执行系统水平上的多组学数据整合分析。
因此一个项目课题的复杂程度有时候不亚于一场小型战斗,诸位项目规划者,需要根据目标、成本、时间、质量来制定方案。其中,最为重要的部分,是保证各个子项目内容高效相互协作,而不仅仅是“伴随同时进行”。
这里有个关键概念:“兵力分散、火力集中”,也就是通过不同类型的技术路线去探索项目的核心目标。
样本或队列筛选时,低成本多维度高效的“侦查兵”先撒上去,即HE、IHC、NGS去挑选样本和靶标,以及军队都现代化了,科研人员以查文献为先导就不用说了 ,前置性工作。

然后,你需要炮兵去轰目标,也就是拿相对较低成本的技术(比如mIF/mIHC/RNA-seq),先把目标炸一轮,一个可以有点收获,毕竟那里有没有货是验证了,再者,没准能够打开一条狭窄的通道(对,靶标蛋白真的具备独立评估预后的潜力),这一步至关重要,毕竟,炮兵是战争之神,坦克不是。

坦克就是具备突击能力的重型平台(例如scRNA/DSP),请注意精巧的方案讲究多角度“分散”前往目标, 总有一组占领高地,最好是在目标区域形成火力集中交叉(相互验证),稳稳拿下。

灵活多变的步兵(例如RNA-seq /Microarray等数据)不仅可以前期侦查,而且能够最后抵近作战加清理战场,这里不仅是“摸尸体、捡装备”没准出个临床相关的结论,防止今后的同行来观摩学习参考,结果跑了很远来爬山最后看到个小土丘(价值点不够丰富,无法转化);而且!还有地雷还没扫(如果不同平台间数据结果存在不好解释的区别),小伙伴二次挖掘时被炸断了腿,一定会用科研工作者的方式问候你。
分别发扬坦克的突击能力、步兵/步战车的抵近作战能力,通过巧妙的战术配合编组使用,最终达到良好作战效果,这就是步坦协同。根据研究目的、预算、时间,分别发扬各平台的筛选、精研、验证信息的能力,通过精巧的方案和多组学联合分析回答疾病病理机制的问题,就是临床研究的多技术平台联用,如果只是简单无脑的AB俩平台联用,那不叫战术,那叫磕CP。
下面简要介绍一个肿瘤免疫微环境相关的文献,具体展现多技术平台联用方法。
免疫治疗(免疫检查点抑制剂)能够再次激活肿瘤相关的T细胞,诱导持久的肿瘤控制,并给晚期癌症患者带来长期生存。在过往的各类研究中,疗效预测生物标志物已经广泛应用,例如体内高水平的免疫活性、高肿瘤突变负荷(TMB)、微卫星不稳定(MSI-H/dMMR), 甚至包括了肠道微生物中特定的菌群。或许是对于肿瘤免疫应答反应认知的日渐加深,或许是肿瘤基因组层面研究潜力逐渐减弱,肿瘤免疫微环境的相关研究也在整个肿瘤免疫治疗领域扮演着日趋重要的角色。
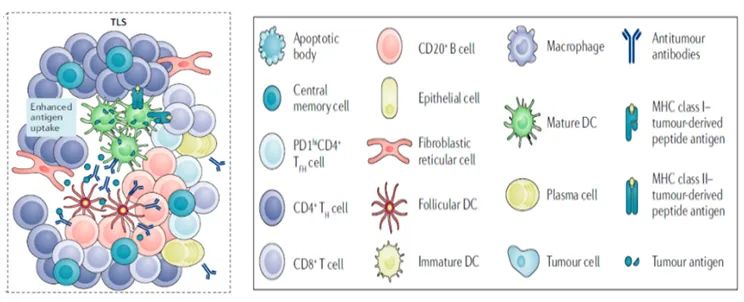
“在癌症治疗方面,我们已经围着T细胞转了一二十年了。”法国免疫学家Wolf Fridman说【1】,T细胞之外的免疫细胞也开始成为研究重点。B细胞是执行体液免疫的主要淋巴细胞,在抗肿瘤反应中发挥着重要作用,但是在既往研究中,B细胞有时被认为促进肿瘤生长,有些研究则发现B细胞与癌症患者良好的预后有关,尤其是当B细胞位于三级淋巴结构(Tertiary lymphoid structure,TLS)之中时【2-4】。三级淋巴结构是在非淋巴结中形成的淋巴结类似结构,可以考虑成突进敌区的一个个堡垒,主体结构是CD4+细胞围绕着CD20+B细胞,其他免疫相关细胞团结在这里,相互作用,可以调节免疫系统对于肿瘤的杀伤能力。
TLS因为其特殊的分布位置以及强大的免疫功能,在肿瘤免疫过程中发挥越来越大的功能。而空间多组学和单细胞转录组学联合的分析策略,可以针对TLS的特殊结构、细胞组成与基因表达情况,深入解析肿瘤的免疫机制和临床免疫治疗,在未来的科学领域将发挥重要的作用。
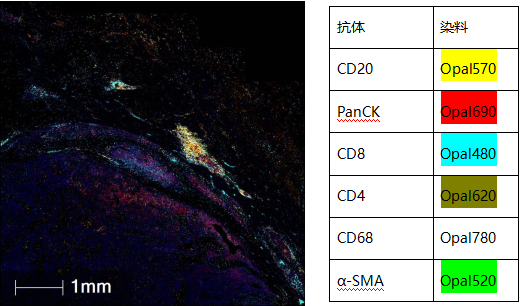
乳腺癌中的三级淋巴结构(图片来源:裕策生物),其中Opal780为远红
TLS是指在慢性炎症发生部位,比如肿瘤等附近产生的淋巴结构。TLS的特点是CD20+B细胞的内部区域被CD3+ T细胞包围,尽管TLS的具体组成可能有所不同,但在T细胞区室中,CD4+T滤泡辅助(TFH)细胞通常代表主要亚群,但CD8+细胞毒性T细胞、CD4+T辅助1(TH1)细胞和调节性T细胞(Tregs)也可以存在。
如何选择研究切入点、技术路线,各层面信息如何联合分析,相互验证,在三级淋巴结构的研究上做好“步坦协同”,2020年隆德大学肿瘤研究中心与哥本哈根大学医院肿瘤科以及其他相关单位合作发表在Nature上的Tertiary lymphoid structures improve immunotherapy and survival in melanoma【4】是一个很好的示范。

该研究的目标是探索与验证黑色素瘤中,三级淋巴结构的存在、定位和患者对于免疫治疗的敏感性和预后。
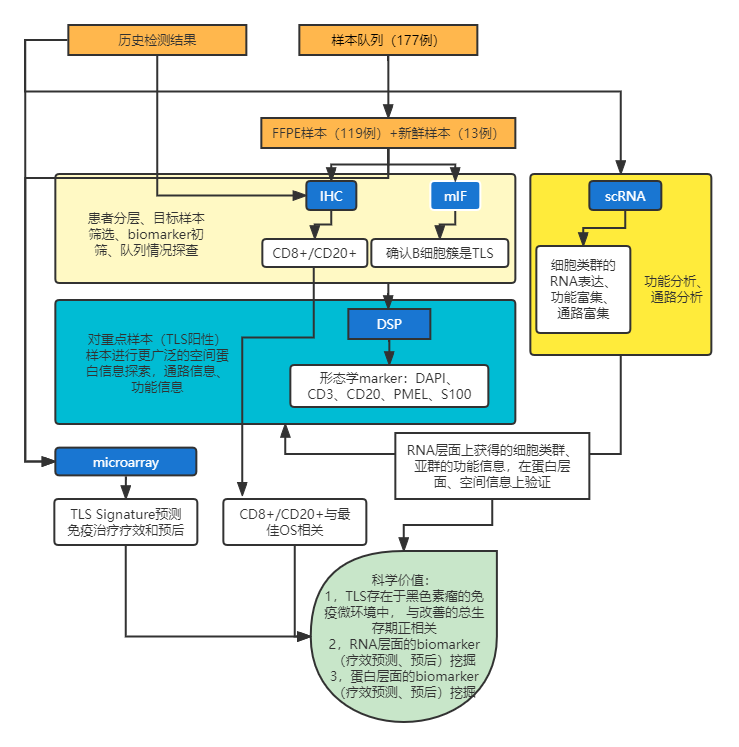
文献阅读笔记——作战地图
研究思路与相关结论
HE、IHC(CD3、CD8、B2M、Ki67、CD20、SOX10)
mIF(CD20、CXCR5、CXCL13)
microarray(Illumina HT12 arrays,1550 genes)

HE染色发现TLS结构,IHC结果显示HE发现的TLS位置存在CD20+B细胞簇(包含Ki67+及Ki67-)及环绕CD20+B细胞的CD4+T细胞,提示TLS的存在。
转录组数据及mIF进一步证实CD20+B细胞簇具有TLS的分子特征,并发现虽然CD8+T细胞主要存在于TLS外,但TLS的存在与肿瘤相关CD8+T细胞的存在相关,表明TLS对CD8+T细胞活化的可能起到支持作用。结果发现,TLS和CD8+T细胞同时存在的患者生存期更长。TIS的空间位置与转移部位无关,具有浸润性TLS的肿瘤同时有更高比例的肿瘤浸润性CD8+T细胞,肿瘤中存在不同类型的TLS(生发样和无生发)。
GeoMx DSP Protein(形态学marker:DAPI、CD3、CD20、PMEL、S10OB,60个免疫相关蛋白,组织芯片,每个样本三个组织芯)
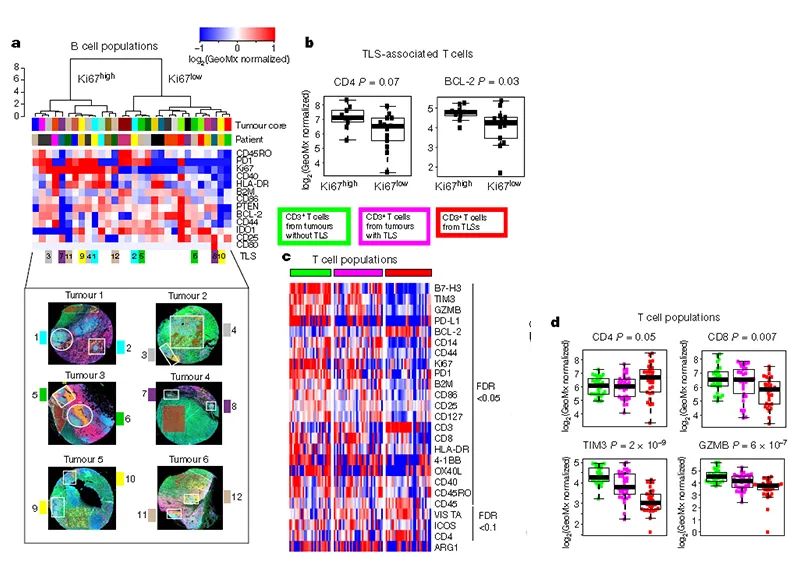
在DSP平台上进一步探索不同T细胞、B细胞及肿瘤细胞群的分子特征。基于DSP数据,存在于TLS的CD20+B细胞可分为Ki67高表达及Ki67低表达,同一肿瘤可能存在不同时期的TLS,证实了IHC的发现。Ki67-high肿瘤相关B细胞CD40表达增加,并且在Ki67-high型TLS中或附近发现的T细胞具有更高比例的CD4+细胞及更高的BCL-2表达,因此这类高增殖B细胞属于成熟型TLS。进一步发现TLS对瘤内T细胞的图谱具有影响,如在TLS中或附近的T细胞相比其他情况的T细胞,具有更高的CD4及更低的CD8表达。此外,在没有免疫细胞存在的肿瘤中,出现抗原呈递缺失,并用IHC、转录组数据、及大Panel进行了进一步确认。
单细胞转录组测序
发现活化及不成熟B细胞的混合物及一小部分浆细胞存在于肿瘤中,进一步支持TLS的存在。一部分B细胞表达类别转化及亲和力成熟基因或生发中心启动的主要调控基因。生发中心启动、明区、暗区及T细胞互作的重要基因在B细胞中显著表达,表明肿瘤中存在不成熟到成熟的生发中心,与IHC和DSP发现的TLS异质性一致。利用已发表的scRNA-seq数据,发现CD69+及IGLL5-CD69+B细胞与ICB应答相关,CD69+B细胞组呈现出更明显的生发中心反应表型,且与成熟生发中心的marker具有相关性。进一步发现B细胞可以改变肿瘤免疫微环境。在单细胞数据中,B细胞富集的样本包含更多具有幼稚和记忆样的CD4+和CD8+T细胞,表明这些细胞流入了TLS,而记忆T细胞与ICB应答改善相关。
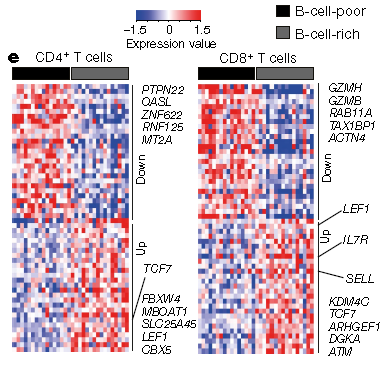
microarray(Illumina HT12 arrays,1550 genes)
通过分析CD20+/CD8+患者的样本microarray RNA表达差异,构建了一个TLS gene Signature,并在单细胞转录组中验证了CCR6、CD79B属于B细胞特异性表达基因,该Signature能够预测黑色素瘤患者对于免疫治疗的临床获益,并在公共数据库中对于此Signature进行了成功的验证。在接受CTLA-4抑制剂的黑色素瘤患者中检测基因表达谱、计算TLS Signature分值,发现TLS Signature分值能显著区分ICB的OS,并在接受CTLA-4和PD-1抑制剂的其他队列中得到了进一步验证。
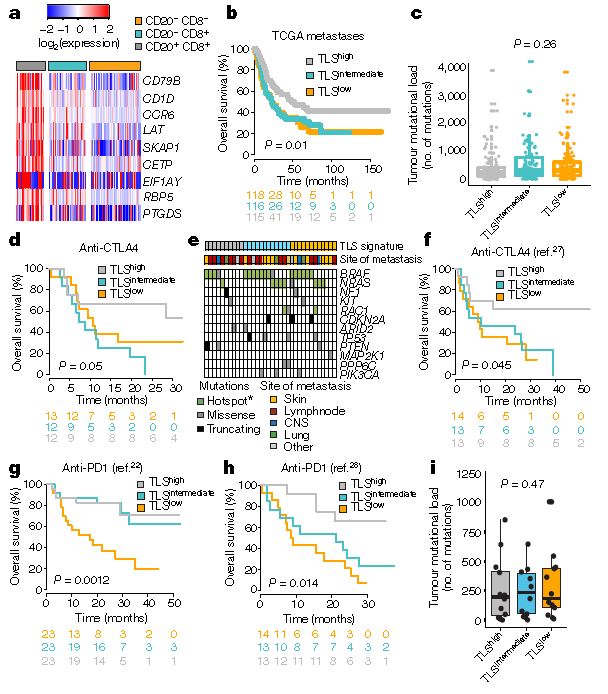
TLS存在于黑色素瘤的免疫微环境中,能够预测免疫治疗(免疫检查点抑制剂)疗效以及预后。
新的技术平台能够解锁新的认知边界,新的认知能够催生新技术,新技术最终将转化为临床应用使更多患者受益于生命科学的进步。
不断拓宽的肿瘤免疫领域需要同时面对样本管理日趋严格、科学问题日趋系统化,因此,选择合适的队列样本与合适的科研问题同样重要。
样本筛选技术着重高效,科研与临床问题探索需要丰富的RNA与蛋白层面的信息,技术着重“多重”、“全面”、“系统”。因此多种技术相结合,在不同的环节发挥优势,并能够联合分析,形成高效、准确的方案,才能为科学研究提供可靠的基础。
肿瘤免疫时空组学科技服务
裕策生物作为国内领先的肿瘤精准免疫组诊疗整体解决方案提供商,希望将其布局的一整套国际前沿的时空组学技术平台共享给中国科研同仁,助力中国科研工作者勇攀学术高峰!

裕策生物时空组学解决方案相关平台
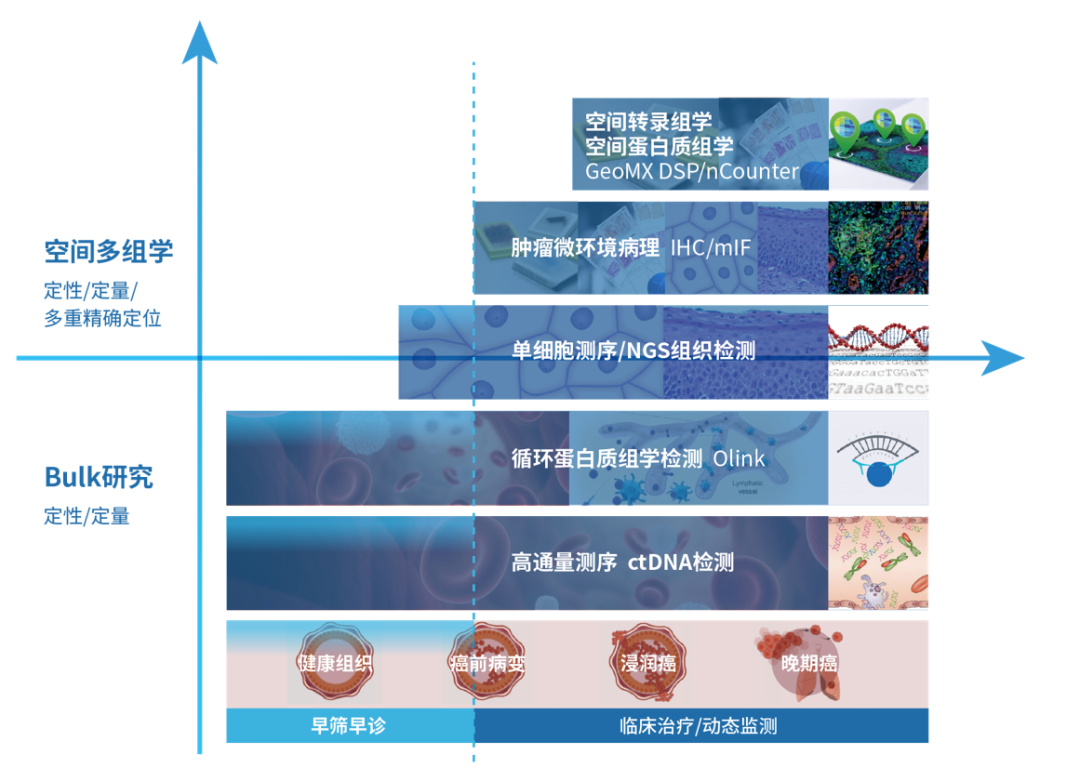
裕策生物肿瘤免疫时空组学示意图
参考文献
[1].https://medicalxpress.com/news/2020-01-scientists-powerhouses-tumours.html
[2].Colbeck E J, Ager A, Gallimore A, et al. Tertiary lymphoid structures in cancer: drivers of antitumor immunity, immunosuppression, or bystander sentinels in disease?[J]. Frontiers in immunology, 2017, 8: 1830.
[3].Dieu-Nosjean M C, Goc J, Giraldo N A, et al. Tertiary lymphoid structures in cancer and beyond[J]. Trends in immunology, 2014, 35(11): 571-580.
[4].Sautès-Fridman C, Petitprez F, Calderaro J, et al. Tertiary lymphoid structures in the era of cancer immunotherapy[J]. Nature Reviews Cancer, 2019: 1.
【 返回列表 】
Copyright©2021
深圳裕策生物科技有限公司 版权所有
粤ICP备16128839号

